
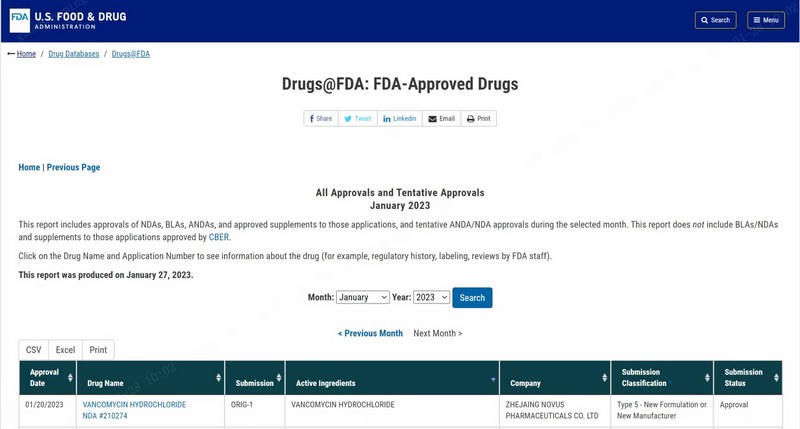
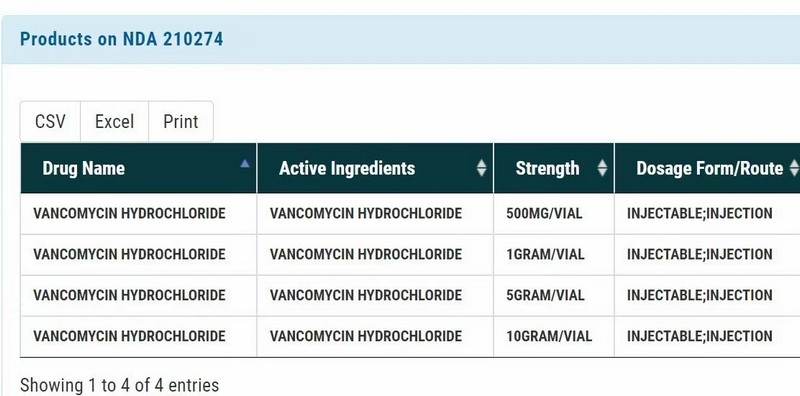
2023年1月21日,農歷壬寅年除夕,在這樣一個國人辭舊迎新、吃團圓飯的喜慶日子里,浙江醫藥股份有限公司下屬子公司浙江創新生物有限公司收到美國食品藥品監督管理局(FDA)核準簽發的注射用鹽酸萬古霉素 500mg/瓶、1g/瓶、5g/瓶、10g/瓶四個規格按 505(b)(2)申報的 NDA(New Drug Application)新藥申請批準信。這是對一種全新的無菌藥品商業生產模式的認可,代表著民族藥企又取得了一個在要求最高、監管最嚴的歐美發達國家市場展示自我和同臺競爭的機會,這對于浙江醫藥和創新生物都是具有里程碑意義的重大事件。另一方面,承載本次獲批產品的生產技術平臺具有工藝流程全封閉、高產量、適合大小規格產品、連續工藝、生產成型時間短等特點,可以生產常規凍干工藝無法生產或難以生產的產品,優勢十分明顯;實踐證明以這種全新的生產方式來制備高難度藥品這條路是走得通的,這項突破性的技術平臺,將具有良好的前景,預期在今后能為公司帶來較大的效益。
回顧FDA的四輪審評歷程,第一次再遞交是對第一輪NDA審評CRL100多項缺陷整改和完整答復;第二輪審評中除了FDA因疫情無法現場檢查外,NDA文件已無其它技術問題;第三、第四輪審評重點在于說明書和標簽,其中第四輪審評時FDA啟動了設施的記錄審查,并在本輪審評后最終獲得NDA批準。
多年的耕耘和堅持終于有了豐碩的成果,成果的取得來自于浙江醫藥及創新生物董事會和經營層堅定如磐的決心和科學有力的指導,來自于注射用鹽酸萬古霉素NDA申報項目組和創新生物全體干部員工凝心聚力、攻堅克難和精誠合作。光榮屬于每一個為之付出過努力的浙藥人、創新人!
成績屬于過往,創新生物將以此為新的起點,新的征程,開拓創新,勇敢前行,共同建設更加美好的未來!
看創新,鯤鵬起,北海可期!
![]()

文:創新生物辦公室 俞志榮
圖:網絡截圖